Возможности применения реконструктивно-пластических операций при хирургическом лечении больных раком молочной железы
ФГБУ Московский научно-исследовательский онкологический институт им.П.А.Герцена (дир.-акад.РАМН В.И.Чиссов)
Кафедра онкологии и радиотерапии ФПП ОВ 1-го МГМУ им. И.М.Сеченова
(ректор член-кор.РАМН П.В.Глыбочко)
Волченко А.А., Пак Д.Д., Чиссов В.И.
В России в структуре злокачественных опухолей рак молочной железы (РМЖ) с 1996 года уверенно занимает первое место. Показатель заболеваемости на 100000 населения составляет 45,75. Число женщин, у которых впервые выявлена злокачественная опухоль молочной железы, в течение последних 10 лет увеличивается в среднем на 3,6% ежегодно [1].
Современная стратегия хирургического лечения РМЖ направлена на решение двух задач: надежности излечения от рака и создание условий для реконструкции молочной железы[2].Органосохраняющая хирургия при начальных стадиях РМЖ начала развиваться наиболее активно с середины 70-х годов прошлого столетия [3].
В настоящее время существует множество вариантов объема оперативного вмешательства при органосохраняющем лечении больных РМЖ, показаниями к проведению которого является опухоль 3-4 см, соотношение размера опухоли и молочной железы, позволяющее выполнить радикальное вмешательство, моноцентричный рост, отсутствие данных о наличии отдаленного метастазирования, желание пациентки сохранить молочную железу [4].
Наиболее известным на сегодняшний момент объемом оперативного вмешательства является квадрантэктомия – удаление вместе с опухолью и прилежащей нормальной ткани молочной железы как минимум в пределах двух-трех сантиметром от опухолевого узла; туморэктомия – локальное хирургическое иссечение опухоли.
Цель органосохраняющего лечения состоит в том, чтобы при хороших косметических результатах достичь частоты местных рецидивов, сопоставимой с частотой рецидивов после мастэктомии.
У пациентов с опухолью меньше 2 см, при расстоянии опухоли до края резекции 2-3 см при квадранэктомии по сравнению с мастэктомией достигается сопоставимая частота рецидивов: в среднем 2,6% в течение 6 лет наблюдения. Попытки достигнуть лучшего косметического результата за счет уменьшения расстояния от опухоли до краев резекции до 1 см при размере опухоли 2,5 см позволяют улучшить косметический результат операции, но частота местного рецидива на протяжении десяти лет наблюдения увеличивается с 7,4% до 18,6% [5-6].
Косметический результат после проведения органосохраняющего лечения в некоторых случаях может быть неудовлетворительным, а вместе с тем проведение радикальной мастэктомии будет являться чрезмерным лечебным мероприятием [21].
На сегодняшний день в данной ситуации есть методики онкопластической хирургии, которые объединили в себе принципы радикального онкологического хирургического лечения и пластической хирургии [7].
При проведении органосохраняющего лечения косметический дефект удаленного объема и формы железы устраняется перемещением оставшейся части железы или используется объем других собственных тканей [19-20].
Показанием для проведения органосохраняющего лечения с применением онкопластических методик является необходимость удаления более 20% ткани молочной железы при среднем и большом размере молочной железы для получения хорошего косметического результата[11-15].
Решение о применении необходимой онкопластической техники принимается в зависимости от локализации и размера первичного опухолевого узла, соотношения размера опухолевого узла и молочной железы, формы и объема молочной железы, возраста и желания самой пациентки. Стоит воздержаться от методик онкопластической хирургии у пациентов с отечно-инфильтративной формой рака, при мультицентрическом росте опухоли [3].
Радикальная мастэктомия относительно успешно решает лечебную задачу, вместе с тем реконструкция молочной железы весьма затруднительна, что связано с восстановлением значительного дефицита кожи, мягких тканей в отсутствии их резервов, созданием объема, формы железы, сосково-ареолярного комплекса (САК) и переходной складки, обеспечением симметрии молочных желез [8-11].
Подкожная мастэктомия оптимально решает обе задачи: сохраняя высокий уровень радикализма оперативного вмешательства, существенно облегчает первичную реконструкцию молочной железы, позволяя достигнуть лучшего эстетического результата. Эстетические преимущества сохранения кожи железы очевидны. Проведенные исследования продемонстрировали онкологическую безопасность данного типа операций [12,22].
Показаниями к проведению подкожной мастэктомии является средний/малый размер молочной железы, мультицентрический рост, обширные участки микрокальцинатов на маммограмме, что может быть признаком широкого распространения карциномы in situ, неблагоприятное соотношение размеров опухоли и молочной железы. На решение об объеме оперативного вмешательства оказывает влияние личный выбор пациента [16-17].
Вместе с тем, удаление САК значительно ухудшает эстетический результат реконструкции молочной железы, что заставляет онкологов предпринимать попытки к его сохранению, так как нет надежных методик имитации соска и ареолы. Со временем размеры искусственно созданного соска уменьшаются, либо он исчезает, транспортированная или татуированная ареола часто депигментируется. По данным литературы, лишь 16% больных остаются довольны полученными результатом реконструкции САК [18]. Проблема сохранения ареолы и соска при проведении подкожной мастэктомии является весьма сложной. По мнению RusbyJ.E.(2007) процент вовлечения САК в опухолевый процесс составляет 5,6-31% в зависимости от размера первичного опухолевого узла, расстояния до САК, локализации, гистологического типа опухоли, выраженности внутрипротокового компонента, мультицентричности роста, состояния регионарных лимфатических узлов.
Разнообразие модификаций и вариантов реконструктивных вмешательств рождает проблему выбора. На наш взгляд, в отечественной литературе недостаточно полно разработан индивидуальный подход к выбору методики реконструкции молочной железы с учетом всех прогностических факторов и планируемого лечения.
Материалы и методы: В отделении общей онкологии МНИОИ им. П.А. Герцена 170 больным РМЖ выполнены реконструктивно-пластические операции в плане комплексного лечения. В нашем исследовании реконструктивно-пластические операции после органосохраняющего лечения выполнена 115 пациенткам, из них 63 органосохраняющие операции с одномоментным восстановлением утраченного объема замещением экстрамаммарными тканями (с использованием кожно-мышечного и мышечного лоскута широчайшей мышцы спины) и 52 пациенткам - органосохраняющее лечение с использованием редукционных методик маммопластики перемещения дефицита объема собственных тканей молочной железы. 55 больным выполнена подкожная мастэктомия с сохранением САК и одномоментная реконструкция силиконовым эндопротезом (у 15 больных) или комбинации эндопротеза с лоскутами из собственных тканей (у 40 больных).
Возраст больных колебался от 25 до 55 лет, средний возраст 47 лет. Овариально-менструальная функция сохранена у 133 (78,2 %) больных, 37 (21,8 %) были в менопаузе. Основную группу составили пациенты начальных стадий:I-IIaст-128 (75,3%), IIb-42 (24,7%).
Для определения распространенности опухолевого процесса выполнялась маммография, ультразвуковое исследование молочной железы, печени и органов малого таза, радионуклеидное исследование костей скелета, рентгенография органов грудной клетки. До начала лечения диагноз подтвержден цитологическим исследованием тонкоигольного пункционного биоптата из первичной опухоли и регионарных лимфатических узлов.
После оперативного вмешательства проводилось плановое гистологическое исследование первичной опухоли, краев резекции, окружающих тканей и регионарных лимфатических узлов.
Морфологическое строение рака оценивалось по Международной гистологической классификации опухолей молочной железы (ВОЗ 2003г.). Наиболее часто диагностировался инвазивный протоковый рак – 133 (78,2 %) и инвазивный дольковый рак – 25 (14,7 %), комбинированные формы протокового и долькового рака - 12 (7,1%).
Независимо от объема оперативного вмешательства большинству больных, проведено комплексное и комбинированное лечение 159 (93,5 %). Только хирургическое вмешательство было у 11 (6,5%) больных. Проведена оценка косметических результатов лечения, онкологические результаты оценены по показателям 5-летней общей и безрецидивной выживаемости.
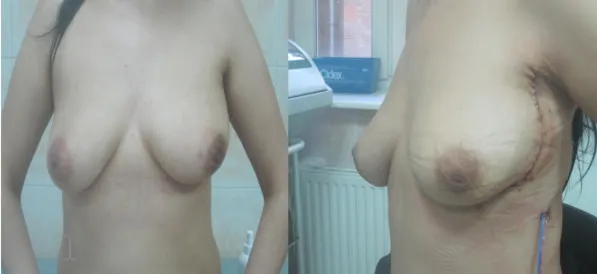
Результаты: 63 больным органосохраняющее лечение выполнено с замещением объема фрагментом ШМС. В настоящий момент для замещения утраченного объема железы для достижения лучшего косметического результата и меньшей травматизации донорской зоны мы используем лоскуты широчайшей мышцы спины без кожи (торакодорзальный мышечный лоскут) (фото 1).
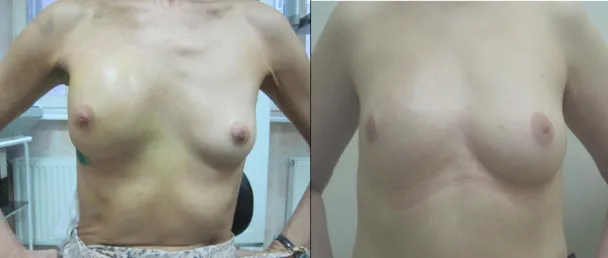
Особенность редукционных методов маммопластики заключается в том, что утраченный объём МЖ восполняют путем мобилизации гландулярной ножки, включающей деэпитализированный железисто-жировой лоскут с сосково-ареолярным комплексом, ее перемещение в зону резекции и формировании окончательного вида МЖ(фото 2).
 Фото№1.
Фото№1.
Эстетический результат органосохраняющего лечения методиками замещения объема мышечным лоскутом широчайшей мышцы спины.
Фото№2.
Эстетический результат органосохраняющего лечения редукционными методиками перемещения объема.
В зависимости от локализации первичного опухолевого процесса гландулярная ножка может быть верхней, нижней, медиальной. Органосохраняющее лечение перемещением объема собственных тканей молочной железы с использованием редукционных методов маммопластики выполнено 52 больным РМЖ. 27 (51,9%) пациенткам при локализации опухоли в верхних квадрантах произведена органосохраняющая операция с перемещением сосково-ареолярного комплекса на нижней гландулярной ножке, 13 (25,0%) при локализации опухоли в нижних квадрантах произведена операция с использованием верхней гландуляроной ножки, 12 (23,1%) при локализации опухоли в наружных квадрантах выполнено органосохраняющее лечение используя медиальную гландулярную ножку.
При восстановлении формы и объема молочной железы, риск обнаружения опухоли в краях резекции обусловливает выполнение срочного интраоперационного морфологического исследования: после резекции опухоли со стенок полости и из субареолярной зоны берутся соскобы. Отсутствие роста опухоли при срочном цитологическом исследовании является показанием к одноэтапной операции.
При обнаружении опухолевых клеток выполняется ре-резекция краев резекции. Отсутствие опухолевого роста позволяет выполнить органосохраняющую операцию, если при ре-резекции обнаруживаются опухолевые клетки, больной выполняется радикальная или подкожная мастэктомия. После цитологического исследования стенки полости полностью повторно иссекаются и этот материал направляется на плановое гистологическое исследование.
Следует отметить, что онкопластические методики позволяют иссекать большой объем ткани молочной железы и при проведении планового гистологического исследования у 3 (1,8%) пациенток выявлен мультицентричный рост опухоли, что потребовало выполнения радикальной мастэктомии.
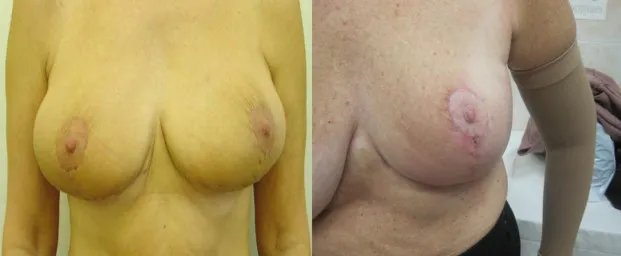
Подкожная мастэктомия с сохранением сосковоареолярного комплекса выполнена 55 больным РМЖ. Наиболее широко используемыми методиками реконструкции после проведения подкожной мастэктомии с сохранением САК является использование мышечного лоскута на питающей ножке из фрагмента широчайшей мышцы спины и его комбинация с протезом - 37 (67,3%), субпекторальная реконструкция протезом/или экспандер-эндопротезом Бэккера - 15 (27,3%), кожно-жирового лоскута на питающей ножке прямой мышцы живота - 3(5,4 %) (фото№3).
Фото№3
Эстетический результат подкожной мастэктомии с сохранением САК. Наиболее простым с технической точки зрения способом восстановления молочной железы является эндопротезирование. Некоторые пациентки настроены только на эндопротезирование, предпочитая этот наименее травматичный метод реконструкции. Наряду с эндопротезированием применялась методика более сложного протезирования с помощью так называемого экспандер-эндопротеза Бэккера.
Метод заключается в размещении тканевого экспандера под большую грудную мышцу на месте удаленной молочной железы, с вынесенным в сторону портом, для последующего постепенного наполнения протеза физиологическим раствором. Достоинством этого метода является, во-первых, постепенное растяжение кожных покровов и тем самым создание кармана для протеза большего объема, а во-вторых, возможность изменения объема путем добавления или удаления физиологического раствора позволяет более точно подобрать размер железы.
Для успешного эндопротезирования необходимо надежное укрытие протеза хорошо кровоснабжаемыми тканями.
Самый известный в пластической хирургии лоскут из широчайшей мышцы спины, питающийся за счет торакодорзального сосудистого пучка, на сегодняшний день очень часто используется в качестве пластического материала при реконструкции молочной железы после подкожной мастэктомии. В ходе операции на спине выкраивается горизонтальный кожный лоскут вместе с подлежащей широчайшей мышцей спины, либо только лоскут широчайшей мышцы спины, сохраняя торакорзальную артерию с веной, входящие в мышцы по переднему ее краю в области подмышечной впадины. Затем лоскут проводится через подкожный тоннель в зону дефекта, образовавшегося после подкожной мастэктомии.
Большая площадь широчайшей мышцы спины, высокая мобильность лоскутов, возможность сохранения автономного питания, несущественность функциональных потерь донорской зоны, исключительная пластичность трансплантатов на питающей ножке, обусловили успех применения широчайшей мышцы спины в реконстуктивно-пластических операциях.
Несмотря на недостатки торакодорзального лоскута, в плане объема после подкожной мастэктомии, хорошее кровоснабжение, надежность, простота и возможность восстановить недостающую после мастэктомии объем, делают его очень удачным в комбинации с эндопротезированием.
Одним из важных условий успеха применения этой методики является возможность сохранить достаточное количество покровных тканей оперированной железы. Запас мягких тканей позволяет создать полноценный «карман» для эндопротеза нужного объема.
Отсутствие необходимости забирать большое количество мягких тканей на спине сводит к минимуму травму донорской зоны, делая косметический дефект не столь значительным. Проблема объема восстанавливаемой железы решается только за счет эндопротеза.
Появление на рынке достаточного количества современных, различных по объемам и формам эндопротезов, несомненно, способствует более широкому использованию метода в клинической практике.
Послеоперационные осложнения реконструктивно-пластических операций развились у 12 из 170 больных, что составило 7,1%. Наиболее частым, послеоперационным осложнением явилось нагноение послеоперационной раны у 8 (4,7%) больных.
Факторами, способствующими нагноению раны, служило проведение химиолучевой терапии, сопровождающейся сухим или влажным эпителиитом, снижающей общую сопротивляемость организма и репаративные способности тканей, а также лимфорея, создающая благоприятную среду для развития микроорганизмов.
При нагноении раны проводилось лечение в соответствии с требованиями гнойной хирургии - более широкое дренирование раны, промывание антисептическими растворами, общая антибактериальная терапия в соответствии с выявленной патогенной флорой и ее чувствительностью к лекарственным препаратам, общеукрепляющее лечение. Некроз кожных лоскутов, связанный не столько с чрезмерным натяжением, истончением лоскута, сколько с нарушением васкуляризации наблюдался у 4 больных (2,4%).
При возникновении некроза основное внимание уделялось ограничению дальнейшего распространения и предупреждению нагноения.
Следует подчеркнуть, что все осложнения хорошо поддавались терапии и существенно не сказывались на состоянии больной.
Оценка косметических результатов является сложной проблемой. Наиболее часто используемое в публикациях деление на отличный, хороший, удовлетворительный и неудовлетворительный результаты не совсем корректно.
Представить эти результаты в единицах измерения невозможно. Мы использовали простую схему: результат был либо удовлетворительный, либо неудовлетворительный. Его определяла пациентка, как бы подводя итог реконструкции вместе с корригирующими операциями, в виде ретроспективной оценки, стоил ли полученный результат тех усилий и времени, которые были затрачены. Косметического результата лечения оказался удовлетворительным у 91,7% пациенток.
Срок наблюдения за данной группой больных составил от 1,77 до 120,8 месяцев, в среднем - 25,5 месяца. За период наблюдения прогрессирование опухолевого процесса выявлено у 29 (17,1%) больных: отдаленное метастазирование у 15 (8,8%), местные рецидивы у 6 (3,5%) при органосохраняющем лечении и у 2 (1,2%) при проведении подкожных мастэктомий с сохранением СА|
При выполнении реконструктивно-пластического этапа показатели общей 5-летней выживаемости составили 86,5 ± 2,7 % (р>0,05), безрецидивная выживаемость при 5-летнем сроке наблюдения - 68,8 ± 3,4 % (р>0,05).
Пластическая хирургия при РМЖ на сегодняшний день занимает важное место в комплексе реабилитационных мероприятий. Разнообразие модификаций и вариантов реконструктивных вмешательств рождает проблему выбора, которую необходимо решать совместно с пациенткой.
На наш взгляд, в отечественной литературе недостаточно полно разработан индивидуальный подход к выбору методики реконструкции молочной железы с учетом всех прогностических факторов и планируемого лечения.
Для определения показания и противопоказания к каждому из использованных методов реконструкции молочной железы, имеющему свои преимущества и недостатки, мы сравнили их по нескольким позициям. Первая - это оценка метода с точки зрения реципиентной зоны, то есть эффект собственно реконструкции. Вторая - оценка донорской зоны, ее возможности как источника материала, и ущерб, который может быть ей нанесен.
Третья - оценка методики с точки зрения ее технической сложности.
Несмотря на выбор наиболее подходящего в том или ином случае способа хирургического лечения, эстетический результат операции зависит от различных факторов, таких как местоположение и размер дефекта, а так же размер исходной МЖ. Разработанный нами алгоритм использования реконструктивно-пластических операции заключается в следующем.
При большом и среднем размере молочной железы и малом размере опухолевого узла нами используются редукционные методики органосохраняющего лечения, либо методики замещения аутологичными лоскутами или комбинации их с эндопротезом при среднем и большом размере первичной опухоли.
При малом размере молочной железы вне зависимости от размера первичного опухолевого узла мы отдаем предпочтение подкожной мастэктомии с сохранением САК с одноментной реконструкцией эндопротезом или комбинацией с аутологичными лоскутами.
Следует обсуждать с пациенткой возможность выполнения коррегирующих операций с целью достижения симметрии на контралателальной молочной железе.
Обобщая все вышесказанное, онкопластическая хирургия включает ряд хирургических методик, позволяющих произвести безопасную резекцию злокачественного новообразования и одномоментно закрыть получившийся дефект местными тканями или с помощью отдаленных лоскутов, чтобы получить удовлетворительный эстетический результат. Основываясь на полученных результатах, условно можно расположить методы реконструкции по уменьшению возможностей, которые он дает в следующей последовательности.
На первом месте, в настоящее время, стоит метод органосохраняющего лечения с перемещением и замещением объема ткани молочной железы.
Он позволяет переместить максимальное количество мягких тканей и в большинстве случаев полностью восстановить объем, естественность формы (включая птоз) и симметрию.
На второе место в нашей практике сегодня вышла реконструкция эндопротезом при проведении подкожной мастэктомии с сохранением САК и/или ее комбинация с мышечным торакодорзальным лоскутом по своим косметическим возможностям не уступает другим тканевым трансплантатам. Данный метод превосходит ранее используемый кожно-мышечный торокадорзальный лоскут, а техническая простота делает метод наиболее предпочтительным. Третьим по своим возможностям мы считаем TRAM-лоскут на мышечной ножке. Он значительно проигрывает двум предыдущим по ущербу, наносимому донорской зоне и технической сложности проведения.
Данный вид восстановления молочной железы выполняется нами только при невозможности использования других методов или по настоятельной просьбе пациентки.
СПИСОК
ЛИТЕРАТУРА

 Москва, ул.Кусковская вл. 1А, стр 4
Москва, ул.Кусковская вл. 1А, стр 4 +7 (495) 128-37-76
+7 (495) 128-37-76
